FDA 批准抗生素治疗无并发症的尿路感染

据Utility Therapeutics网站介绍,pivmecillinam(口服)是一种氨基青霉素,是一类特殊的β-内酰胺抗生素,具有独特的作用机制。pivmecillinam是mecillinam的前药,在体内迅速转化为mecillinam。 图片来源:FDA 今天,FDA 批准了一种抗生素 Pivmecillinam (Pivya),用于治疗女性单纯性尿路感染。 “无并发症的尿路感染是影响女性的一种非常常见的疾病,也是使用抗生素的最常见原因之一,”FDA 药物评价和研究中心抗感染部门主任 Peter Kim(医学博士、理学硕士)说道。1 该口服抗菌药物由英国生物技术公司 Utility Therapeutics 开发,并被批准用于治疗由以下原因引起的尿路感染: 大肠杆菌、奇异变形杆菌和腐生葡萄球菌。1 研究结果今天的批准基于其 3 期临床研究的数据。 具体而言,3 项对照临床试验评估了匹美西林治疗 18 岁或以上女性无并发症性尿路感染的疗效,这些临床试验将不同的匹美西林给药方案与安慰剂、另一种口服抗菌药物和布洛芬(一种抗炎药)进行了比较。1 这三项试验的疗效的主要衡量标准是综合缓解率,其中包括临床治愈(试验开始时患者存在的简单性尿路感染症状得到缓解,并且没有新症状)和微生物学反应(证明细菌培养试验开始时患者尿液中的含量减少)1。 患者入组研究后约 8 至 14 天评估综合缓解率。 在比较 pivmecillinam 和安慰剂的临床试验中,接受 pivmecillinam 的 137 名受试者中有 62% 达到了复合缓解,而接受安慰剂的 134 名受试者中只有 10% 达到了复合缓解。 在将 Pivya 与另一种口服抗菌药物进行比较的临床试验中,接受 Pivya 治疗的 127 名受试者中有 72% 达到了复合缓解,而接受对照药治疗的 132 名受试者中这一比例为 76%。1 在里面 […]
FDA 批准 ImmunityBio 的膀胱癌治疗

美国食品和药物管理局周一批准了一种治疗膀胱癌的新疗法。 据一家公司称,该疗法将以 Anktiva 品牌销售,旨在治疗某些患有某些类型非肌层浸润性膀胱癌的患者。 FDA声明 宣布批准。 FDA 行动的消息是 路透社首先报道称, “该疗法通过激活称为自然杀伤 (NK) 细胞和 T 细胞的白细胞类型来对抗疾病,从而在体内产生长期免疫力。” 该药物现由卡尔弗城的 ImmunityBio 开发 初步发展 由佛罗里达州米拉马尔的 Altor BioScience 提供。 Patrick Soon-Shiong 博士是 ImmunityBio 的执行主席,他的家族拥有《洛杉矶时报》。 在一份声明中,Soon-Shiong 赞扬了 FDA 的行动,并将 Anktiva 称为“下一代免疫疗法”。 FDA 的批准是基于以下结果 临床试验 由…领着 卡里姆·夏米博士加州大学洛杉矶分校大卫格芬医学院泌尿科副教授。 在加州大学洛杉矶分校健康中心发布的一份声明中,查米表示,这种治疗方法“为已经用尽传统治疗方案的患者提供了一种令人信服的替代方案”。 FDA 表示,Anktiva 适用于对先前治疗没有反应的膀胱癌患者。 Chamie 说,它通过导管输送,并促使患者自身的免疫系统“对癌细胞进行有针对性的攻击”。 他指出,这种治疗可以使一些患者免于侵入性手术,例如切除全部或部分膀胱的手术。 根据加州大学洛杉矶分校的声明,大多数新诊断的膀胱癌都是非肌肉侵袭性的,即在膀胱内表面的组织中发现的癌症,并且尚未扩散到膀胱壁。 患有这种类型癌症的患者通常会接受手术和直接放入膀胱的基于细菌的免疫疗法。 然而,即使采用这种治疗,癌症也可能复发,并且许多患者对进一步治疗反应不佳,导致一些患者的选择有限。 去年五月, 据路透社报道,FDA“由于该公司申请中的缺陷”拒绝批准该新疗法。 据通讯社报道,FDA 列举了检查中存在的问题,并就如何解决所提出的制造问题提供了坚定的建议。
Natco Pharma 因 Telangana 工厂多项违规行为被美国 FDA 撤回公司新闻

2 分钟阅读 最近更新时间 : 2024 年 4 月 21 日 | 上午 11:33 是 根据美国卫生监管机构的规定,Natco Pharma 未能保持其位于 Telangana 工厂的清洁度,未能按适当的时间间隔对设备和器具进行消毒。 美国食品和药物管理局在给该公司的警告信中表示,其调查人员在位于特伦甘纳邦科图尔村的成品制药厂发现了各种违规行为。 美国食品和药物管理局于2023年10月9日至18日对该设施进行了检查。 “你们的公司未能按照适当的时间间隔对设备和器具进行清洁、维护和消毒和/或灭菌,以防止可能改变安全性、特性、强度、质量或纯度的故障或污染。该药品超出了官方或其他既定要求,”美国卫生监管机构指出。 它还说:“你们对非专用设备的清洁程序不充分。” 美国食品和药物管理局表示,交叉污染并不均匀,对照样品和安慰剂批次的测试未能科学地证明产品不含明显肮脏的设备造成的污染物。 它补充说:“你们没有充分解决从产品接触表面回收的污染问题,也没有意识到其他地点和其他采样可能会发现高水平的污染。” 美国卫生监管机构进一步表示,该公司未能彻底调查批次或其任何组件的任何差异或不符合其任何规格的情况,无论该批次是否已经分发。 USFDA 寻求对您的整个系统进行全面、独立的评估,以调查偏差、差异、投诉、不合规格 (OOS) 结果、差异、故障和记录管理系统。 它说,提供一份报告,评估工作人员是否具备适当的调查能力,有效地进行根本原因分析,并确保纠正措施和预防措施(CAPA)的有效性。 它补充说:“我们承认你们承诺暂时停止在美国市场的所有专用和非专用设备上生产的所有药品的生产,同时纠正 CGMP 违规行为。” 美国食品药品管理局表示,如果制药商计划恢复任何生产业务,请在恢复生产前通知该办公室。 当美国卫生监管机构发现制造商严重违反其规定时,就会发出警告信。 印度是美国以外拥有最多数量的符合美国 FDA 要求的制药厂的国家。 一份报告显示,该国拥有超过 600 个经美国 FDA 注册的生产基地,占美国境外所有注册生产基地的近 12.5%。 (只有本报告的标题和图片可能已由商业标准工作人员重新修改;其余内容是从联合源自动生成的。) 首次发布: 2024 年 4 月 21 日 | 上午 […]
FDA 批准 Sub-Q Vedolizumab 用于克罗恩病维持治疗
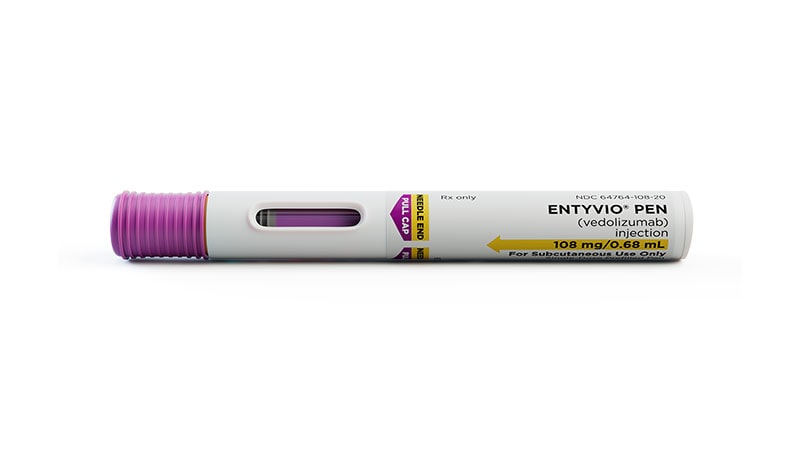
美国食品和药物管理局(FDA)已批准皮下注射 维多珠单抗 (Entyvio)用于中度至重度活动性成人的维持治疗 克罗恩病 (CD) 静脉注射 (IV) 维多珠单抗诱导治疗后。 在此之前,FDA 去年批准了皮下注射维多珠单抗 (vedolizumab) 维持治疗 患有中度至重度活动的成年人 溃疡性结肠炎 (加州大学)。 人源化免疫球蛋白 G1 单克隆抗体以单剂量预填充笔 (Entyvio Pen) 形式提供。 美国食品药品监督管理局 首次批准 2014 年,该生物制剂的静脉注射制剂用于治疗不能耐受其他疗法或此类疗法失败的中重度 UC 和 CD 患者。 皮下注射维多珠单抗用于 CD 维持治疗的批准基于 3 期、随机、双盲、安慰剂对照 VISIBLE 2 试验。 该试验招募了 409 名患有中度至重度活动性 CD 的成年患者,他们在第 0 周和第 2 周接受两剂开放标签 IV 维多珠单抗后,在第 6 周出现临床反应。 第 6 周时,他们以 2:1 的比例随机分配,每 […]
FDA 批准第二种 Ustekinumab 生物仿制药

美国食品和药物管理局 (FDA) 已批准生物仿制药 ustekinumab-aekn (Selarsdi) 用于治疗中度至重度 斑块状银屑病 和 银屑病关节炎 成人和 6 岁或以上儿童患者。 这是监管机构批准的第二个乌特克单抗生物类似药,也是冰岛制药公司 Alvotech 与 Teva Pharmaceuticals 合作在美国批准的第二个生物类似药。 Ustekinumab (Stelara) 是一种靶向白细胞介素 (IL)–12 和 IL-23 的人单克隆抗体。 该药物由强生公司生产,仅 2023 年销售额就接近 70 亿美元。 新闻稿。 Alvotech 董事长兼首席执行官在新闻稿中表示:“明年初将 Selarsdi 在美国上市提供了一个重要机会,可以改善患者获得炎症性疾病重要生物制剂的机会,并有助于减轻医疗保健成本的通胀压力。” 这 第一个乌司奴单抗生物仿制药ustekinumab-auub (Wezlana) 于 2023 年 10 月 31 日获得 FDA 批准,可与参考产品互换。 这使得药剂师可以用生物仿制药替代参考产品,而无需处方临床医生的参与(根据州法律)。 除银屑病和银屑病关节炎外,ustekinumab-auub 还被批准用于治疗中度至重度活动性 克罗恩病 和 溃疡性结肠炎。 Ustekinumab-aekn 没有可互换性名称,并且未被批准用于克罗恩病或溃疡性结肠炎。 […]
FDA 对死亡后栓塞装置进行 I 级召回

制造商波士顿科学公司的一项调查确定,肠道缺血的高风险与通过等分技术(栓塞手术的常见输送方法)输送预混合栓塞剂治疗下消化道(GI)出血有关。 美国共有 1,594 台设备被纳入召回范围,这是一项纠正措施,而不是产品下架。 FDA 在其 I 级召回公告中表示:“最严重和最常见的不良健康后果是需要进行大手术,例如肠切除术和/或结肠造口术。” “通过等分技术使用该产品可能会阻止血液和氧气流向包括小肠(缺血)或非目标栓塞在内的器官,所有这些都可能导致住院时间延长、需要额外的手术或死亡。” 为了解决这个问题,波士顿科学公司向其客户发出紧急咨询,警告“不建议将等分技术用于 Obsidio Embolic 的下消化道出血栓塞手术,因为这会增加患者的风险”,并呼吁立即提供此信息张贴在产品附近。 迄今为止,已报告 11 起与肠缺血问题相关的事件,其中 7 人受伤,2 人死亡。 栓塞阻断是一种 FDA 批准,一次性产品,适用于富血管肿瘤的微创栓塞,并阻断出血或出血的外周血管中的血流。 FDA 解释说,注射后,预混合栓塞剂“在血管中形成固体模型并阻止血液流动”。 伊恩·英格拉姆 是 MedPage Today 的总编辑,帮助报道该网站的肿瘤学。 请启用 JavaScript 才能查看 评论由 Disqus 提供支持。 1713393057 2024-04-17 21:09:47
FDA 宣布召回与死亡和受伤有关的心脏泵

FDA 表示,一对与数百人受伤和至少 14 人死亡有关的心脏装置已受到 FDA 最严重的召回 周一宣布。 此次召回发生在外科医生表示他们首次注意到由雅培实验室子公司 Thoratec Corp. 制造的 HeartMate II 和 HeartMate 3 存在问题的几年后。 这些设备目前尚未从市场上撤出。 雅培在一封电子邮件回复中表示,今年已向客户传达了这一风险。 延迟的行动给一些安全倡导者带来了关于如何以及何时报告已批准的医疗设备的问题的问题。 正如 KFF 健康新闻去年底的一项调查所述,这些有问题的心脏装置与数千起患者受伤和死亡的报告有关。 “为什么公众不知道?” 说 桑克特·杜鲁瓦是加州大学旧金山分校的心脏病专家和医疗器械安全与监管专家。 尽管一些外科医生可能已经意识到了问题,但其他外科医生,尤其是那些不经常植入设备的外科医生,可能一无所知。 “他们的患者正在遭受不良事件,”他说。 此次召回涉及一对机械泵,当心脏无法自行泵血时,可以帮助心脏泵血。 这些装置小到可以放在手掌中,被植入正在等待移植的终末期心力衰竭患者体内,或者在无法进行移植时作为永久解决方案。 此次召回影响了近 14,000 台设备。 HeartMate 3 是一款专为终末期心力衰竭患者设计的机械泵,由 Abbott Laboratories 子公司 Thoratec Corp. 制造。 HeartMate 3 被称为左心室辅助装置,可帮助心脏的主泵室将血液泵送到身体的其他部位。 该设备可供等待心脏移植或长期治疗的患者使用。 该设备由连接到泵的电缆供电,并通过手术开口从身体引出,并连接到控制器和电池或其他电源。 制造商的使用说明书。 (图:Abbott Laboratories 2017 年说明书,第 38 页。同样的图也出现在 2022 […]
FDA 改变对苹果酱引起的铅中毒事件的调查方法

对某些肉桂苹果酱产品中铅的联邦调查的一部分已转入后续状态。 美国食品和药物管理局的新方法旨在提供事件后响应行动。 根据 FDA 4 月 16 日发布的最新消息,该机构将继续开展监测活动以及预防和合规活动。 美国疾病控制与预防中心正在继续监测铅中毒的爆发,最近报告称有 519 名儿童在此次爆发中受到影响。 疫情蔓延至 44 个州。 FDA已收集了此次疫情中的90份“不良事件”报告。 两个机构使用不同的报告方法,因此它们的数字可能有所重叠,不应加在一起。 疾病预防控制中心继续增加患者数量。 此外,食用受铅污染的肉桂苹果酱和检测到血液中重金属含量升高之间可能存在显着的滞后时间。 三个品牌的袋装肉桂苹果酱已被召回并面向儿童销售。 他们是瓦纳巴纳、施努克斯和韦斯。 只有肉桂苹果酱产品受到牵连。 2023 年 9 月中旬,北卡罗来纳州公共卫生官员首次向 FDA 通报了苹果酱中的铅含量。 10 月 28 日,FDA 与生产商讨论了厄瓜多尔 Astrofoods 生产的肉桂苹果酱中铅的分析结果。 同样在 10 月 28 日,FDA 向美国消费者发出警告。 最终确定铅来自从第三方供应商购买的受污染的肉桂。 FDA 报告称,肉桂中添加铅可能是为了增加肉桂的重量,从而增加其商业价值。 调查的其他关键日期包括: 2023 年 10 月 29 日,Wanabana LLC 通知其客户召回 WanaBana 苹果肉桂果泥产品。 2023 […]
FDA 测试发现进口蜂蜜中掺有其他甜味剂的比例

FDA 发布了一份关于对进口蜂蜜及其为了经济利益而故意掺假的调查的报告。 美国食品和药物管理局的报告包含来自 25 个国家的 107 个样本的信息。 FDA 收集的样品处于进口状态,这是指在进入国内商业之前在入境口岸或其他存放地点收集的产品。 该机构于 2022 年和 2023 年测试了零售和散装样品。零售样品由单个罐子或其他容器组成。 批量运输样品通常是从桶或桶中收集的。 所有样品都被标记为“蜂蜜”。 FDA 在 2021 年和 2022 年进行了类似的抽样和测试计划。这些测试显示 14% 的样品是故意掺假的。 蜂蜜掺假通常涉及添加未声明的甜味剂,这些甜味剂比蜂蜜便宜,例如来自甘蔗、玉米、大米或甜菜的糖浆。 这种掺假通过增加蜂蜜的重量人为地提高了蜂蜜的价值,并可能给食物过敏的人带来问题。 “在收集和检测的 107 个进口样品中,FDA 发现 3 个进口样品(占 3%)违规。 虽然违规样品数量较 2021-2022 年进口蜂蜜分配略有减少,但这两项分配并不是为了进行统计比较而设计的,”FDA 的报告称。 来自多米尼加共和国、墨西哥和也门的蜂蜜被发现掺假。 此外,FDA 还增加了筛查和监视抽样,或将相关公司和产品列入进口警报 (IA) 99-47。 上列出的产品 进口警报 受到“不经体检拘留”的处罚。 对于那些要进入美国的产品,该公司必须向 FDA 提供证据以克服违规行为,例如第三方实验室的测试结果,证明该产品不含有添加甜味剂。 FDA 报告称:“结果再次证实,该机构有必要继续测试蜂蜜是否出于经济动机掺假,以确保消费者不被欺骗,并获得公平的购买价值。” 1712777227 2024-04-10 04:05:00
FDA 审查雅培心脏设备小组的十名医生与该公司有财务关系

当 FDA 最近召集一个顾问委员会来评估雅培生产的心脏设备时,该机构没有透露其中大多数人已收到该公司的付款或进行了该公司资助的研究——这些信息在联邦数据库中很容易获得。 根据美国卫生与公共服务部维护的数据库,FDA 咨询委员会的一名成员与雅培公司支付的数百笔款项有关,总计近 20 万美元。 另一项涉及 100 笔付款,总计约 10 万美元,并在雅培 (Abbott) 约 5 万美元的支持下进行了研究。 该委员会的第三位成员从事研究工作,并得到了该公司超过 18 万美元的资助。 政府数据库,称为“开放式付款”记录了医生与某些其他医疗保健提供者以及药品和医疗设备制造商之间的财务关系。 KFF Health News 发现了与 FDA 顾问小组 14 名投票成员中的 10 名相关的雅培付款记录,该小组正在权衡名为 TriClip G4 系统的心脏设备的临床证据。 这笔钱是从 2016 年到 2022 年(数据库显示付款的最近一年)支付的,总计约为 65 万美元。 专家组几乎一致投票认为该设备的好处大于其风险。 雅培公司于 4 月 2 日宣布 FDA 已批准 TriClip,该产品旨在治疗心脏三尖瓣渗漏。 雅培的付款说明了医疗行业资金的影响范围以及 FDA 透明度的限制。 他们还阐明了该机构如何权衡其顾问小组成员与这些委员会在监管审批过程中审查的药品和医疗器械制造商之间的关系。 这些付款并不反映该机构、其外部专家或设备制造商的不当行为。 数据库并未显示任何付款与 […]
