抗过敏性休克的肾上腺素鼻喷雾剂获欧洲药品管理局 (EMA) 批准
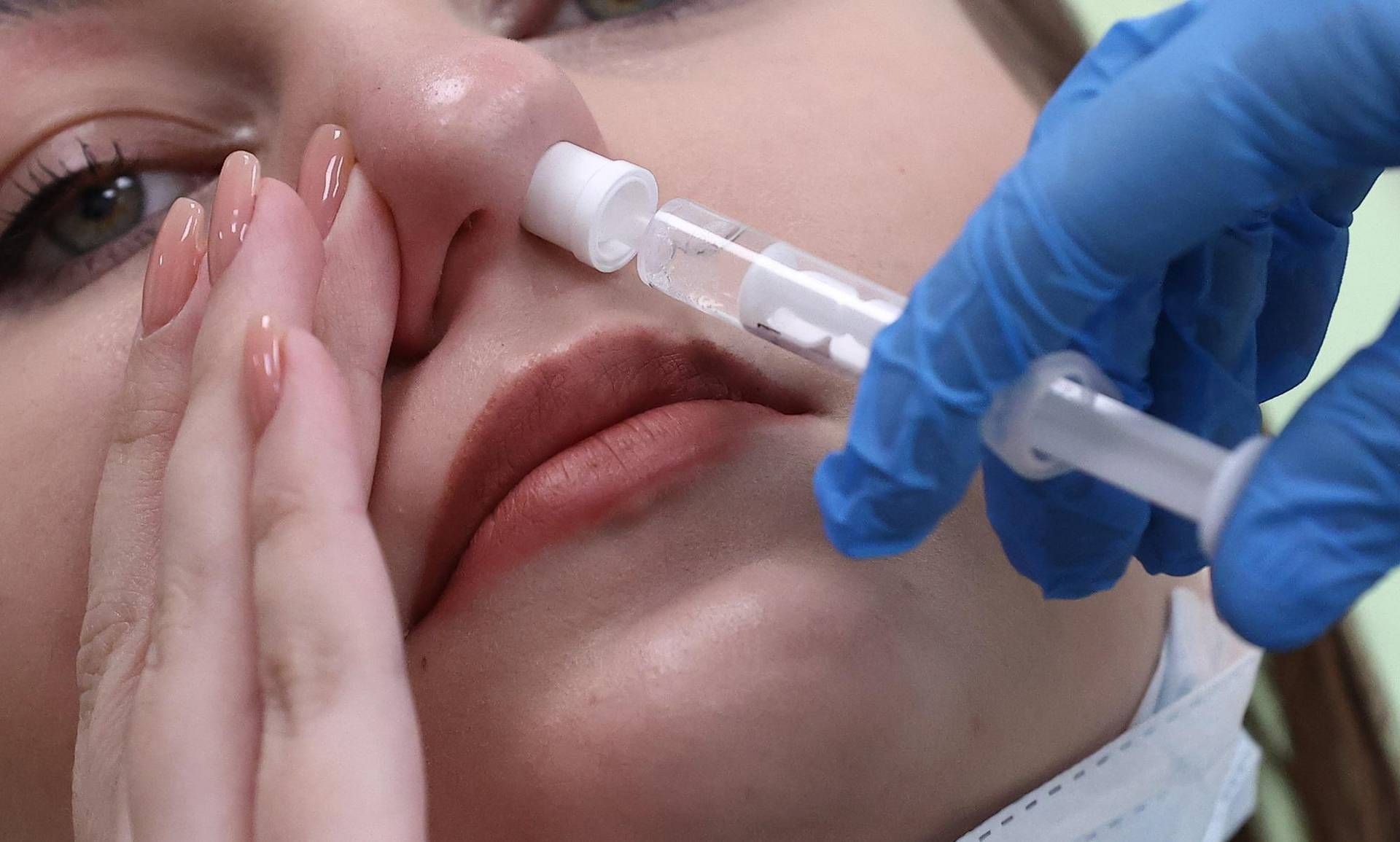
EMA 批准首款肾上腺素鼻喷雾剂上市,用于治疗严重过敏症中可能致命的过敏性休克。欧洲药品管理局人用药品委员会 (CHMP) 建议在欧盟授予基于肾上腺素的 Eurneffy* 上市许可 (MA)。这是一种注射剂型的替代品,用于紧急治疗过敏反应,即最危险的过敏反应形式。 根据欧洲过敏和临床免疫学会 (Eaaci) 的数据,欧洲过敏和临床免疫学会 (EMA) 回忆称,过敏是欧洲最普遍的慢性疾病,2015 年有 1.5 亿人受到影响。约 20% 的严重过敏患者每天都生活在致命过敏性休克的恐惧之中。过敏反应可能在接触过敏原几分钟内突然发生,过敏原通常包含在食物或药物中,或通过昆虫叮咬携带。诊断和治疗的延迟可能导致气道阻塞或心血管衰竭,甚至死亡。 欧盟监管机构解释称,注射肾上腺素(也称肾上腺素)可减轻过敏反应。这种物质与特定受体(称为肾上腺素能受体)结合,可减轻因过敏原释放的组胺引起的血管扩张和通透性。肾上腺素还能放松肺部的平滑肌。因此,这种治疗可改善血液流动和呼吸。尽管事实证明,如果使用得当,肾上腺素自动注射器非常有效,但紧急治疗有时会因各种因素而被推迟或无法实施,包括对针头的恐惧、便携性差,以及担心没有接受过医疗培训的人可能会注射这种药物。肾上腺素鼻喷雾剂提供了一种更方便的“B 计划”:它能被鼻粘膜迅速吸收,并分布到全身。 EMA 解释称,出于道德和实际原因,无法对患有持续严重过敏反应的人群进行 Eurneffy 疗效的对照临床研究,但关于使用肾上腺素治疗严重过敏的信息非常丰富,而且该物质目前是治疗过敏反应的标准疗法。 Eurneffy 的疗效和安全性在 14 项临床试验中对 537 名 19 至 55 岁的健康人群进行了评估。这些研究将 Eurneffy 与肌肉注射肾上腺素的药物进行了比较,分析了血压和心率,以及活性成分在体内的吸收、变化和排出方式。通过鼻腔喷雾剂给药的肾上腺素的有机作用与传统注射剂相当。Eurneffy 未报告任何重大不良事件;最常见的不良事件与注射相似(例如恶心、头痛、喉咙刺激和头晕),但也包括鼻部不适和流鼻涕。 CHMP 还建议采取具体措施来避免不当使用喷雾装置的风险,包括针对患者和操作员的培训视频和其他数字教育材料。对于这些群体,还将提供用于教育目的的 Eurneffy 模型,让您可以模拟喷雾的正确使用。 1719592589 #抗过敏性休克的肾上腺素鼻喷雾剂获欧洲药品管理局 #EMA #批准 2024-06-28 12:19:00
FDA 批准 Vyvgart Hytrulo 用于 CIDP
美国食品药品管理局 (FDA) 已批准 埃夫加替莫德 阿尔法和 透明质酸酶-qvfc (Vyvgart Hytrulo, argenx) 用于治疗成人 慢性炎症性脱髓鞘性多发性神经病 (CIDP),一种罕见且常常使人衰弱的自身免疫性疾病。 Efgartigimod 阿尔法透明质酸酶是首个获批用于治疗 CIDP 的新生儿 Fc 受体阻滞剂,以每周一次 30 至 90 秒的皮下注射形式提供。 该公司在宣布获得美国批准的新闻稿中指出,在第三阶段 ADHERE 研究中,69% 接受该药物治疗的患者(无论之前是否接受过治疗)都显示出临床改善的证据,包括活动能力、功能和力量的改善。 该研究达到了其主要终点,表明风险比降低了 61%。 [HR],0.39; 磷 < .0001) 与安慰剂相比,复发风险降低,99% 的研究参与者选择参与 ADHERE 开放标签扩展研究。 GBS/CIDP 基金会执行董事 Lisa Butler 在新闻稿中表示:“这项有希望的 CIDP 新治疗方案获批可能为患者带来希望,使他们能够治疗疾病,而不仅仅是控制症状。CIDP 患者应该得到治疗选择,我们期待未来有更多最佳和个性化的治疗选择。” ADHERE 试验首席研究员、明尼阿波利斯明尼苏达大学神经病学系教授医学博士 Jeffrey Allen 补充道,这项批准标志着“CIDP 治疗的突破性一天”。 Allen 表示:“现有的 CIDP 治疗仅限于皮质类固醇和血浆衍生疗法。这些治疗虽然对许多患者有效,但对某些患者来说可能难以接受。” 艾伦补充道,Vyvgart […]
FDA 批准 Adagrasib 用于治疗 KRAS G12C 突变的结直肠癌

美国食品药品监督管理局 (FDA) 已加速批准 剂量增加 (Krazati、Mirati Therapeutics, Inc.) 西妥昔单抗 对于某些 KRAS G12C 突变患者 结肠直肠癌 (CRC)。 CRC 的批准是基于 KRYSTAL-1 多中心、单组扩展队列试验报告称,在 94 名入组患者中,总体反应率为 34%。 所有反应均为部分反应,中位反应持续时间为 5.8 个月,其中 31% 的反应患者的反应持续时间至少为 6 个月。 患者每天两次接受 600 毫克阿达拉西布治疗,同时每两周接受 500 毫克/平方米西妥昔单抗治疗2 剂量或初始剂量 400 mg/m2 随后每周服用 250 mg/m2. 停止使用 adagrasib 的患者也必须停止使用西妥昔单抗,但如果停止使用西妥昔单抗,则可以继续使用 adagrasib。 根据 处方信息。 接受治疗的患者中至少有 20% 出现不良反应,包括皮疹、恶心、腹泻、呕吐、疲劳、肌肉骨骼疼痛、肝毒性、头痛、皮肤干燥、腹痛、食欲下降、水肿、 贫血、咳嗽、头晕、 便秘以及周围神经病变。 休斯顿德克萨斯大学 MD 安德森癌症中心的医学博士 Scott Kopetz […]
阿根廷在抗议参议院批准米莱宏观法律期间发生骚乱

布宜诺斯艾利斯阿根廷参议院批准了《阿根廷人自由基础和起点法》,这是哈维尔·米莱在就任阿根廷总统前不久就一直在推动的宏观立法项目。去年 2 月,众议院否决了该法案,行政部门将条款削减了近一半,以获得 4 月的多数票。但该法案需要参议院的批准,参议院在 12 个多小时的现场谈判会议中于本周三达成了技术平局,最终以失败告终 在边缘 由国家副总统兼众议院议长维多利亚·维拉鲁埃尔(Victoria Villarruel)起草。现在,文本返回众议院,进行修订、批准并成为法律。在布宜诺斯艾利斯的国会广场,数千人表达了对该法律的反对,至少有 22 人被警方拘留,警方使用催泪瓦斯、水炮和橡皮子弹镇压示威者。政府迅速向安全部队表示祝贺,并谈到恐怖主义和政变企图。 订阅国际新闻通讯 看似遥远的事情比以往任何时候都重要 注册 反对《基地法》的口号是“祖国不可出售”,事实上,批评者认为米莱伊的计划将阿根廷的主权交给了资本:“这是对我们已获得权利的倒退,因为我们 40 年来从未见过民主”,62 岁的帕洛玛在议会广场对阿根廷共和国广播电台说。法律规定的劳动改革使工人得不到保护,他们无权获得解雇补偿,但他们自己必须建立基金,每月从工资中扣除一笔资金;试用期延长,最长可达一年;对未登记工人的雇主的罚款被取消,此外,自雇人员的配额增加了三倍,还有其他措施。 另一个症结是大型投资激励计划 (RIGI),这是一系列针对 2 亿美元以上外国投资的税收减免。最令人担忧的是,在环境问题或土地保有权方面缺乏监管,而且大型外国投资往往与采矿、石油、天然气和能源有关。“他们正在放弃我们的自然资源,这是阿根廷最宝贵的资产,”40 岁的教师马塞洛哀叹道。但政府也不得不在会议期间做出让步,并承诺明确规定只有部分生产部门(而不是所有生产部门)才能从 RIGI 中受益。 “完全不确定” 除此之外,国家系统性资金削减和已经发生的私有化也令人担忧:在短短六个月内,米莱已经解雇了公共部门的 10 多万名正式员工,并终止了数千份合同。“我们生活在完全不确定的状态中”,34 岁的克劳迪娅解释道:她是国家研究系统的一名科学研究员,该系统获得的资金越来越少。在微观层面,购买力和消费大幅下降。“米莱不知道一个家庭没有任何收入会是什么感觉,也不知道不得不在购买或支付医疗保险之间做出选择。” 最后,参议院投票赞成将特别权力授予米莱伊。这是一项特殊授权,以便行政部门可以暂时行使宪法赋予立法权的一些权力。几位参议员认为这项措施是轻率的,因为米莱伊上周在接受采访时宣称,他喜欢成为“从内部摧毁国家”的“鼹鼠”,并将自己比作终结者,将“终结者”定义为“来自世界末日的未来,以避免它”的人。今天早上,参议院投票结束后,米莱伊就启程前往意大利参加七国集团会议和将在瑞士举行的乌克兰和平峰会。未来几天,他计划会见乔治亚·梅洛尼和埃马纽埃尔·马克龙。总统将返回阿根廷参加两场祖国庆典,并再次前往欧洲,这是他自与佩德罗·桑切斯发生外交危机以来首次访问马德里,他将在那里领取奖项。 1718262327 #阿根廷在抗议参议院批准米莱宏观法律期间发生骚乱 2024-06-13 05:39:56
贸易部长敦促 D-8 成员国完成 PTA 批准

雅加达(安塔拉)——贸易部长祖尔基夫利·哈桑邀请发展中八国经济合作组织(D-8)成员国加快批准进程,并参与 D-8 成员国之间的关税减让合作(D-8 优惠贸易协定,或 D-8 PTA)。 哈桑表示,批准该协议后,D-8 成员国可以充分利用优惠关税,帮助实现 2030 年 D-8 内部贸易额达到 5000 亿美元的目标。 他周三在其办公室发表的声明中指出:“D-8 优惠贸易协定有潜力增加 D-8 内部贸易。因此,D-8 成员国应加快批准进程并加入该优惠贸易协定。印尼已于 2024 年 6 月 1 日开始实施 D-8 优惠贸易协定。” 周二(6 月 11 日),哈桑出席了在土耳其伊斯坦布尔举行的 D-8 贸易部长理事会非正式会议。 该部长解释说,目前,D-8 成员国之间的贸易额为 1700 亿美元,目标是到 2030 年达到 5000 亿美元。 自2006年在巴厘岛举行的第五届D-8峰会上所有D-8贸易部长签署该协议以来,迄今为止,八个D-8成员国中已有五个批准了该协议。这五个国家是印度尼西亚、孟加拉国、伊朗、马来西亚和土耳其。 哈桑肯定地表示:“我相信,D-8 优惠贸易协定的实施可以通过开拓新市场、进行技术转让和促进贸易领域的繁荣,为商业参与者,特别是微型、小型和中型企业(MSMEs)带来利益。” 他还建议发展中八国集团采取大胆举措,建立全面跨区域经济伙伴关系协定(CTREPA)作为新的战略伙伴关系。 此外,部长们还签署了《D-8优惠贸易协定争端解决机制(DSM)议定书》,该议定书于2024年3月5日在孟加拉国举行的D-8贸易部长理事会(TMC)第三次会议上通过。DSM议定书对于促进D-8优惠贸易协定的实施具有重要意义。 哈桑表示,印尼支持批准《争端解决机制议定书》,以确保高效、透明、公平和可预见的贸易争端解决程序,从而增进 D-8 成员国之间的信任。 此外,预计D-8成员国将立即批准D-8《损害赔偿协议》,并通知D-8秘书处。 他在闭幕发言中重申了印尼愿意在明年主持 D-8 会议的意愿。他还强调了合作对继任 D-8 峰会的重要性。 […]
美国批准一种治疗阿尔茨海默病的新药
美国食品药品管理局 (FDA) 周一一致批准礼来公司针对阿尔茨海默病的实验性治疗药物 donanemab 的益处大于其风险,并同意试验数据表明其对早期患有阿尔茨海默病并有记忆力丧失的患者有效。 此次投票为 FDA 就该疗法做出最终决定扫清了道路,该决定最初预计在今年早些时候该机构召开会议之前做出,以便其独立专家小组能够参与讨论。 礼来公司药物开发主管 Dawn Brooks 在投票后接受采访时表示:“我们很高兴咨询委员会认可了 donanemab 的强大积极益处。”她说,现在,在委员会的一致支持下,该公司希望 FDA 能够完成审查。 研究人员周一表示,2023 年 7 月,礼来公司证明,其实验药物通过尽早治疗阿尔茨海默病患者(最好是在他们出现这种大脑破坏性疾病的症状之前)取得了更好的效果。这是治疗最常见痴呆症的一项有希望的新进展。 疾病进展减缓高达 60% 根据在阿姆斯特丹举行的阿尔茨海默病协会国际会议上公布的一项试验,Donanemab 已被证明能减缓记忆和思维问题的进展约三分之一,但如果患者在仅有轻度障碍时开始服用该药,这一比例将翻倍至 60%。礼来公司的这款新药是百健公司的 Eisai 和 Leqembi 的潜在竞争对手,后者于 7 月获得美国批准。 1718142660 #美国批准一种治疗阿尔茨海默病的新药 2024-06-11 09:11:15
雅培非处方连续血糖监测仪获得 FDA 批准
/cdn.vox-cdn.com/uploads/chorus_asset/file/24816340/236730_Nutrisense_glucose_monitor_AKrales_0011.jpg)
雅培 今天宣布 美国食品药品监督管理局已批准两款新型非处方连续血糖监测仪 (CGM)。Lingo 专为注重健康的消费者设计,他们希望更深入地了解自己的新陈代谢情况。而 Libre Rio 则专为不依赖胰岛素的 2 型糖尿病患者设计。 CGM 是一种小型可穿戴传感器,通常一次佩戴约 14 天。它们实际上并不测量您的血糖,而是测量皮肤下间质液(细胞之间的物质)中的葡萄糖。到目前为止,它们通常用于依赖胰岛素治疗的 1 型或 2 型糖尿病患者。然而,医疗设备制造商和健康技术初创公司越来越希望了解这项技术是否可以帮助非胰岛素依赖型糖尿病患者、糖尿病前期患者或希望改善代谢健康的人。 根据雅培 新闻稿, 行话 旨在成为 18 岁及以上人群的“消费者可穿戴设备”。与雅培的 FreeStyle Libre CGM 一样,它戴在上臂上 14 天,血糖数据可以发送到智能手机应用程序。在应用程序中,用户将能够查看有关一个人对某些食物、运动和压力的反应的指导见解。然而,作为一种健康设备,它并不打算用于诊断任何代谢紊乱或指导糖尿病治疗。 然而,Libre Rio 针对的是不使用胰岛素,而是通过改变生活方式来控制病情的 2 型糖尿病患者。它将能够跟踪 40 至 400 mg/dL 之间的血糖范围。雅培并不是唯一一家追求这种 CGM 的公司。今年早些时候,Dexcom 宣布 CGM碑,一款非处方动态血糖监测产品,同样针对不使用胰岛素的 2 型糖尿病患者。Stelo 还 获得 FDA 批准 预计将于今年夏末抵达。 OTC CGM 的吸引力在于它们提高了可及性。通常,CGM 需要处方才能获得,这可能会阻止那些从技术上讲“不需要”CGM […]
联合国安理会批准美国加沙停火提议

El Consejo de Seguridad de la ONU aprobó este lunes la resolución presentada por Estados Unidos de apoyo a la propuesta de tregua que presentó el presidente Joe Biden el 31 de mayo, en la que se establece un plan de tres fases para poner fin a la guerra en Gaza. La resolución fue aprobada […]
FDA 批准 Imetelstat 用于治疗罕见的低风险血癌
美国食品药品管理局(FDA)已批准 伊美特尔统计 (Rytelo,Geron Corporation)用于治疗某些复发或难治性低风险至中等风险骨髓增生异常综合征(MDS)患者。 具体来说,该首创寡核苷酸端粒酶抑制剂已获得孤儿药资格,适用于输血依赖的MDS成人患者 贫血 根据 FDA 的规定,需要在 8 周内输入 4 个或更多红细胞单位,并且对红细胞生成刺激剂没有反应,或者对红细胞生成刺激剂失去反应或不适合使用红细胞生成刺激剂的患者 新闻稿。 “对于依赖输血的低风险 MDS 和贫血患者,我们目前几乎没有选择,而且经常循环使用可用的疗法,因此 RYTELO 的批准可能会改变我们的实践,”佛罗里达州坦帕市莫菲特癌症中心的联合研究员 Rami Komrokji 医学博士在 Geron Corporation 的报告中表示 公告 的批准。 批准是基于随机、安慰剂对照、第 3 阶段临床试验的有效性和安全性结果 IMerge 试用版研究发现,与安慰剂组相比,治疗组红细胞输血独立性显著提高。 患者接受 7.1 mg/kg imetelstat 或安慰剂输注,每 28 天为一个周期,直至病情进展或出现不可接受的毒性。所有患者均接受支持性治疗,包括红细胞输注。 imetelstat 组 8 周或以上红细胞输血独立率为 39.8%,安慰剂组为 15%。治疗组 24 周或以上红细胞输血独立率为 28%,安慰剂组为 3.3%。 对实现至少 8 周红细胞输血独立性的患者进行的探索性分析显示,治疗组的血红蛋白中位增加量为 3.6 g/dL,而安慰剂组为 0.8 […]
FDA 批准 GSK 的呼吸道合胞病毒疫苗用于 50-59 岁成年人

2023 年 5 月,葛兰素史克公司的 Arexvy 成为首个获得 FDA 批准的呼吸道合胞病毒疫苗。EPA-EFE 提供的照片 6 月 8 日(联合通讯社)—— 美国食品药品监督管理局批准葛兰素史克公司的呼吸道合胞病毒疫苗用于治疗50至59岁的高危成年人,扩大了该疫苗对年轻患者的接种范围。 葛兰素史克 阿雷克斯维 2023 年 5 月成为首个获得 FDA 批准的 RSV 疫苗。当时,该疫苗仅被批准用于 60 岁及以上的成年人,这些人更容易患上严重的 RSV 下呼吸道疾病。 葛兰素史克公司首席科学官托尼·伍德周五在一份声明中表示:“今天的批准反映了将呼吸道合胞病毒疫苗的益处扩大到 50 至 59 岁高风险成年人的重要性。”“对于患有基础疾病的人来说,呼吸道合胞病毒可能会带来严重后果,因此我们很自豪能够成为第一个帮助他们预防呼吸道合胞病毒-LRTD 的公司。” 该公司向 FDA 提交的批准申请是根据一项 后期试验 研究显示,50 至 59 岁高危成人对疫苗的免疫反应与 60 岁以上成人接种疫苗的免疫反应相似。 副作用包括轻度至中度疲劳、头痛和肌肉疼痛。 据葛兰素史克公司称,超过 1300 万 50 至 59 岁的美国人患有一种疾病,这种疾病会增加他们患上严重呼吸道合胞病毒感染的风险。据估计,该病毒每年导致 2,000 名 50 […]
