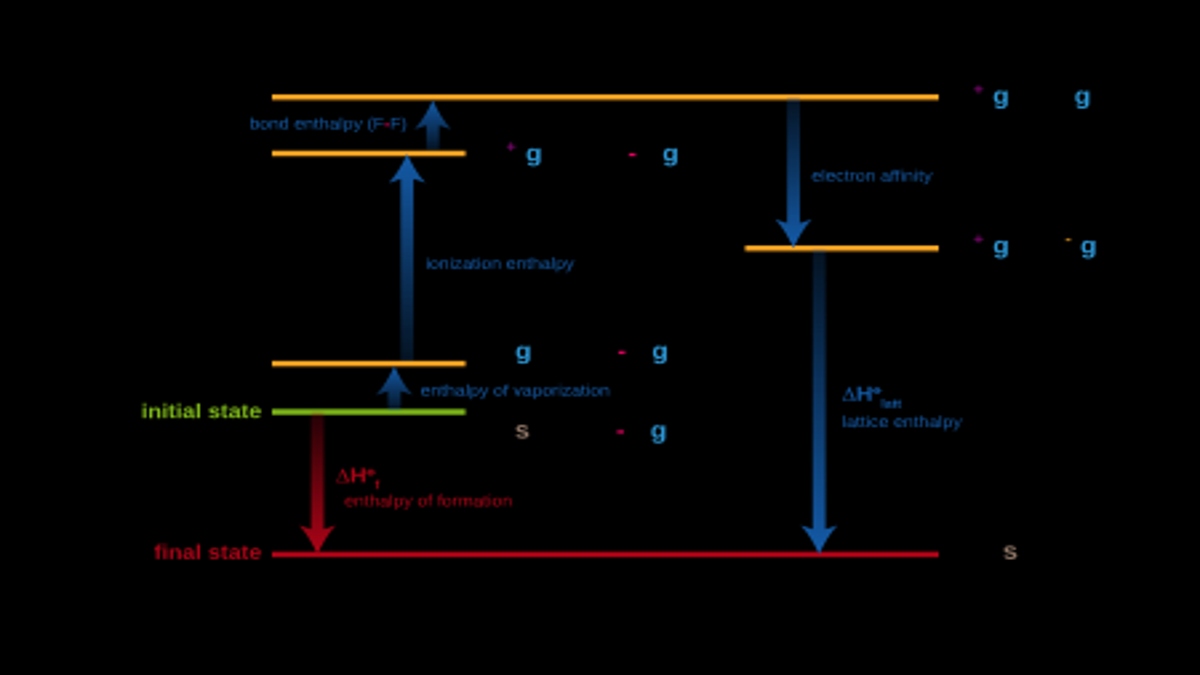
标准生成焓的变化是理解热化学的重要内容之一。然而,在热化学中,焓无法准确计算。因为可以计算的是焓ΔH,这是化学反应的伴随物。当发生化学反应时,它与热量的吸收或释放同时发生。
另请阅读: 化学反应方程式、条件和物质
其实,这种情况在日常生活中经常发生,只是我们没有意识到而已。在化学反应中,焓就是结束和开始之间的差值。
那么它的压力为 1 个大气压,温度测量值为 298 K。符号为 H 或热量,最终焓为产物焓,初始焓为反应物。
化学反应中的标准生成焓变化
标准生成焓变化的含义是1摩尔物质在25度、1个大气压的标准状态下反应焓的变化。所以单位是kj/mol。
标准生成焓变的定义与焓变不同。由于化学反应发生时焓变发生在自由量或吸收体系中。
符号为 ΔHfθ 或 ΔfHθ,表示圆形仅在标准条件下发生。这意味着如果它发生在气体中,则标准条件(1 巴)更合适。
这对于溶液中的物质来说有所不同,在 1 bar 的压力下,浓度恰好为 1 M。而纯物质处于凝聚状态,在 1 bar 的压力下,水和纯固体都是凝聚状态。
另请阅读: 放热和吸热反应的定义和特征
对于化学元素的标准变化,1 巴的压力是最稳定的,但要达到一定的温度。例如,在二氧化碳中,1 摩尔产物的书面焓是在标准条件下形成的。所有生成焓的标准为 C (s,graphite) + O2(g) → CO2(g)。
热化学是研究物质热或热量变化的科学。在这种情况下,它涉及化学和物理过程。
这个热化学方程对于反应过程很重要。此外,它还与反应物、能量和产物的摩尔数有关。
所以你必须始终注意物质的阶段和书写系数,因为它们会影响焓变。
焓变的类型
标准生成焓变分为几种类型。首先是∆Hc,即标准燃烧焓,当1摩尔可以完全燃烧时就会发生这种情况。
另请阅读: 如何确定反应顺序、图形、逻辑和比较
以下列热化学方程式为例 C2H6(g)+3 ½ O2(g) → 2CO2(g)+3H2O(g) ∆H = -2803 kJ。
第二个有 ∆Hf,是在标准条件下 1 摩尔化合物形成的。例如,在形成 H2O 时,因此 H2(g)+½ O2(g) → H2O(l) ∆H = -285.9 kJ。总之,要从 O2 和 H2 形成 1 摩尔 H@O,所需的能量为 -285.9 kJ。
不仅如此,还有熔化(∆Hfus)和溶解(∆Hcl)。标准熔化,熔点和标准压力改变1摩尔就变成液体。在热化学熔化反应中发生H2O(s) → H2O(l) ∆H=+6.01 kJ。
同时,当 1 摩尔液体变成气体时,就会发生 ∆Hvap 或标准汽化焓。当压力和沸点为标准时,就会发生这种情况。方程式为 H2O(l) → H2O(g) ∆H=+44.05kJ。
另外还有∆Ha,即化合物雾化的标准生成焓。当1摩尔原子以气体形式存在时,就会发生此焓变。
当条件为标准且为物理形式时,该焓由化合物形成。反应方程式为 CH4(g) → C(g)+4H(g) ∆H =+1662 kJ。
对于标准溶解,当 1 摩尔物质变成溶液时,就会发生变化。示例如下,热化学方程中的 NaOH(s) → NaOH(aq) ∆H=+50 kJ。
计数的关键
为了更容易计算标准生成焓变化,需要考虑几个因素。当逆转反应时,ΔH 的大小是相同的。在这种情况下,改变的只是符号,原本为负的变成正的,反之亦然。
然后是平衡反应,乘以乘数。对于 ΔH 量,也乘以与乘数相同的数字。
反应的焓变很容易计算。只需将产物和反应物的生成焓相加即可。
同时,焓的计算并不包括标准条件下的元素。因为,该元素的标准条件为零。
另请阅读: 氧化还原反应概念:电子反应、氧气及其功能
生成焓变是使用每单位物质的能量进行的标准测量。该单位使用千焦耳每摩尔 (kJ mol−1),但您也可以测量卡路里每摩尔、千卡路里每摩尔或焦耳每摩尔。因此,如果它接收能量,则焓为正;如果它释放能量,则焓为负;如果元素自然存在于自然界中,则焓为零。 (R10/HR-在线)
1717376011
#标准生成焓变定义和类型
2024-06-02 23:23:33