美国食品和药物管理局(FDA)已批准皮下注射 维多珠单抗 (Entyvio)用于中度至重度活动性成人的维持治疗 克罗恩病 (CD) 静脉注射 (IV) 维多珠单抗诱导治疗后。
在此之前,FDA 去年批准了皮下注射维多珠单抗 (vedolizumab) 维持治疗 患有中度至重度活动的成年人 溃疡性结肠炎 (加州大学)。
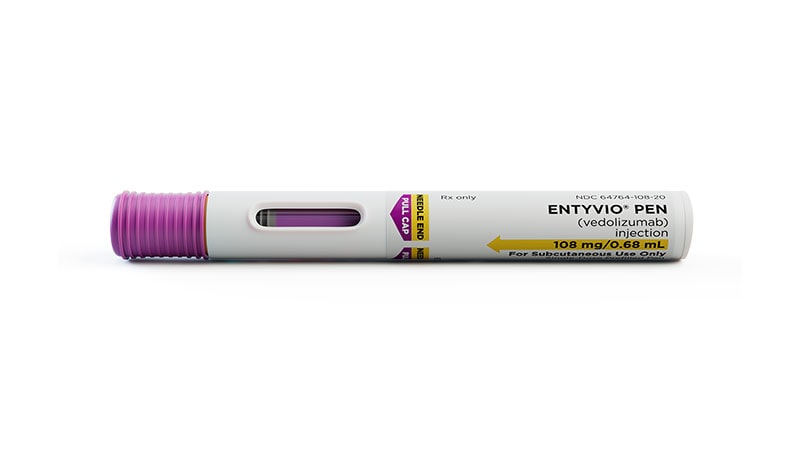
人源化免疫球蛋白 G1 单克隆抗体以单剂量预填充笔 (Entyvio Pen) 形式提供。
美国食品药品监督管理局 首次批准 2014 年,该生物制剂的静脉注射制剂用于治疗不能耐受其他疗法或此类疗法失败的中重度 UC 和 CD 患者。
皮下注射维多珠单抗用于 CD 维持治疗的批准基于 3 期、随机、双盲、安慰剂对照 VISIBLE 2 试验。
该试验招募了 409 名患有中度至重度活动性 CD 的成年患者,他们在第 0 周和第 2 周接受两剂开放标签 IV 维多珠单抗后,在第 6 周出现临床反应。
第 6 周时,他们以 2:1 的比例随机分配,每 2 周接受皮下注射 108 mg 维多珠单抗或安慰剂。 主要终点是第 52 周时的临床缓解,定义为克罗恩病活动指数总分≤ 150。
结果显示,与安慰剂相比,接受皮下注射维多珠单抗的患者显着更多的患者实现了长期临床缓解(48% vs 34%; 磷 < .01),该公司在一份声明中表示 新闻发布。
皮下注射维多珠单抗的安全性总体上与已知的静脉注射维多珠单抗的安全性一致,此外还增加了注射部位反应(包括注射部位红斑、皮疹、瘙痒、肿胀、瘀伤、血肿、疼痛、 荨麻疹和水肿)。
“克罗恩病是一种复杂且通常进行性疾病,适当的管理计划至关重要。作为临床医生,我的首要目标始终是让患者获得缓解,”胃肠道联盟研究高级医疗主任兼助理 Timothy Ritter 医学博士得克萨斯州沃思堡 TCU 伯内特医学院医学教授在新闻稿中说道。
“在 VISIBLE 2 中,约一半接受 Entyvio SC 治疗的患者实现了长期临床缓解。VISIBLE 2 的数据再次证实了 Entyvio 的既定疗效,无论给药途径如何,”Ritter 补充道。
1713566067
2024-04-19 19:15:59