雷蒂克雷氏菌 培养条件和培养方法
本研究使用两种培养基进行培养 雷蒂克雷氏菌。 HS-葡萄糖培养基(2% 葡萄糖,10 g l−1 酵母提取物,10 克/升−1 蛋白胨,2.7 克/升−1 已经2羟基磷灰石4 和 1.3 克/升−1 柠檬酸,pH 5.6–5.8)和椰子水介质(椰子水 (Vita Coco),0.05% (vol/vol) 乙酸)。 椰子水介质通过过滤进行灭菌,需要超过 1 升的情况除外。 在这些情况下,培养基补充剂单独灭菌,并在培养容器中与椰子水混合,椰子水已用无菌技术打开并倒出。
什么时候 雷蒂克雷氏菌 在固体培养基上培养时,始终使用 HS-葡萄糖培养基并补充 1.5% 琼脂。 雷蒂克雷氏菌 液体培养分为以下两种不同的方法:振荡培养和静止培养。 在振荡培养中,使用的培养基补充有 2%(体积/体积)纤维素酶(Sigma-Aldrich,C2730),以允许混浊生长而不会结块。 在静态培养中,目标是形成薄膜,培养基中将补充 1%(体积/体积)乙醇以增强薄膜产量。 在这两种方法中,当质粒维持需要抗生素时,培养基中添加了 340 μg/ml−1 氯霉素或200 μg ml−1 奇霉素。
为了促进接种多个薄膜时的一致性, 雷蒂克雷氏菌 细胞在摇动生长条件下生长直至浑浊,OD 标准化600 穿过样品,通过离心沉淀并在随后的介质中洗涤以去除纤维素酶。 将洗涤后的细胞作为预培养物,以1:25的比例添加到培养容器中,并在30°C下静置以形成薄膜。 在一致形成大薄膜的情况下(>25 cm2),使用甘油等分试样方法。 这 雷蒂克雷氏菌 感兴趣的菌株将在 100 ml HS-葡萄糖培养基中于 30 °C 下振荡生长,直至达到 OD600 约0.6至1。此时,细胞将通过离心沉淀,在HS-葡萄糖培养基中洗涤,然后再次沉淀并重悬于10ml含有25%甘油的HS-葡萄糖培养基中。 将重悬的细胞分成 1 ml 等份并储存在 -80 °C 直至使用。 使用时,将等分试样解冻并添加到最终培养容器中的培养基中。
分子生物学和菌株构建
本研究中使用的 DNA 部分和质粒列在补充材料中。 大肠杆菌 Turbo (NEB) 细胞用于质粒构建。 这 酪氨酸1 DNA 序列从 Twist Bioscience 订购,具有兼容的 3' 和 5' 突出端,可通过 Golden Gate 克隆进入 KTK。 使用 KTK 构建了组成型酪氨酸酶构建体。 参考文献中描述了使用 KTK 的程序和协议。 26。 苏黎世联邦理工学院的 A. Baumschlager 和 M. Khammash 慷慨地将包含 Opto-T7RNAP 系统各个版本的质粒发送给我们。 由于 T7-Opto 编码序列中存在多个与 KTK 不相容的限制性位点,因此使用 Gibson 克隆来构建 p光电-T7RNAP*(563-F2)-目标 质粒和五个 p用于基因组整合的 Opto-T7RNAP 自杀质粒。 补充材料中列出了吉布森克隆的引物。
雷蒂克雷氏菌 电感受态细胞的制备如参考文献所述。 24。 雷蒂克雷氏菌 使用电穿孔转化细胞并选择含有 340 μg/ml 的 HS-葡萄糖琼脂平板−1 氯霉素或 500 μg ml−1 壮观霉素,取决于所使用的质粒选择标记。 请注意,此处在正常培养期间使用较高浓度的壮观霉素。 整合到染色体中的遗传构建体 雷蒂克雷氏菌 是通过使用 pUC19 自杀质粒的同源重组来完成的,如参考文献中所述。 26。
黑化薄膜生产
使用两步法生产黑化薄膜。 首先,一个 酪氨酸1 将表达菌株接种到无菌培养容器中。 通常,使用 24 孔深孔板 (Axygen) 来制作小薄膜。 每孔含有5ml生长培养基,并以1:25的比例接种预培养物。 生长培养基富含 0.5 g l−1 我-酪氨酸和 10 μM CuSO4 促进最高的真黑色素产量。 一旦薄膜达到所需的厚度,将其收集起来,放入无菌 dH 浴中2O并用手轻轻摇动洗涤1分钟。 然后将清洗后的薄膜放入真黑素显影缓冲液浴中。 使用了较大比例的缓冲液与薄膜,即在 50 ml falcon 管中,25 ml 缓冲液中含有一个薄膜; 这是为了防止缓冲液因薄膜中残留的酸而被淹没。 薄膜可在 >30°C 的摇动条件下持续 24 小时产生真黑素。
大规模黑色素薄膜生产
为了生产用于制作钱包的黑色薄膜,对 200 × 300 Eurobox 容器进行了消毒,并填充了 3 升椰子水介质,并补充了 0.5 克升−1 我-酪氨酸,10 μM CuSO4 和1%乙醇。 培养基接种 1 ml 雷蒂克雷氏菌 ctyr1 甘油等分并用纸巾覆盖,然后放入设置为 30°C 的固定培养箱中。 生长 10 天后,收集表膜,在 dH 中短暂洗涤2O 在放入含有 2 l 浓缩真黑素发育缓冲液 (10× PBS) 的 300 × 400 mm Eurobox 中之前。 然后将显影容器放入设定为 45°C 的振荡培养箱中,并在 2 天内产生真黑素,此时纤维素已完全变黑。 然后在高压灭菌之前再次洗涤黑化纤维素以除去过量的真黑素显色缓冲液。 为了使材料在干燥后柔韧,将纤维素片置于 5% 甘油溶液中。 这种甘油工艺可以通过保持湿BC的一些特性、防止角化来提高干燥BC的强度55。 然后将样品压制以除去大量水并风干 24 小时。 由于水分的去除,此过程通常会导致质量减少约 98%。
为了生产用于制造鞋子的黑色薄膜,对一个定制形状的容器进行了消毒,其中包含一个固定紧密拉紧的纱线网络的装置,并填充了 2 升椰子水介质,并补充了 0.5 克升−1 我-酪氨酸,10 μM CuSO4340 微克毫升−1 氯霉素和1%乙醇。 培养基接种约 500 ml 预培养液 K. rhaeticus ptyr1 薄膜。 为了适应补料分批程序和合并纱线设备所需的独特容器尺寸,使培养物在室温下静止条件下生长,直到形成薄薄膜。 此时,在新鲜椰子水培养基中补充0.5 g l−1 我-酪氨酸,10 μM CuSO4340 微克毫升−1 添加氯霉素和 1% 乙醇,将薄膜升高到刚好低于张力纱线的水平。 由于温度较低,经过 2 周的较长生长期后,排干培养基并更换为浓缩真黑素发育缓冲液 (10× PBS)。 将装满的容器放入设定为30rpm的振荡培养箱中,并在30℃下显影1天,此时薄膜已完全变黑。 然后将容器中的真黑素显色缓冲液排空,用 70% 乙醇替换并放置过夜以灭菌。 将乙醇替换为 5% 甘油溶液,然后将黑化纤维素从装置中取出并包裹在鞋形模具(最后一个)上,在 45°C 下风干 24 小时。 风干后,将鞋面和鞋楦放在鞋底上并拍照。
真黑色素产生测定
真黑色素产生测定使用 384 方孔微量滴定板作为反应板。 使用 OT-2 液体处理机器人 (Opentrons) 来准备这些用于测定的反应板。 将显色缓冲液放入深孔板中,使用八通道 300 μl OT-2 Gen2 移液器将 40 μl 转移至反应板的每个孔中。 在使用 OT-2 热模块制备反应板期间,将反应板保持在 4 °C,以减缓真黑色素的产生。 将可能含有酪氨酸酶的细胞和上清液放入 96 孔板中。 使用八通道 20 μl OT-2 Gen2 移液器在一轮抽吸中混合细胞,然后将 10 μl 细胞转移到 384 孔板的每个孔中。 一旦充满,将反应板离心 10 秒,将液体吸至孔底部,然后用 Breath-Easy 密封膜密封。 将反应板放入读板器中并加热至 45°C,以加速真黑色素的产生并防止潜在的细胞生长影响光密度读数。 为了测量反应板中的细胞密度,在 OD 处进行初始测量600 被采取,之后OD405 在 12 小时内每 10 分钟进行一次测量,同时高速摇动板。
真黑色素产生测定(上清液)
雷蒂克雷氏菌 p酪氨酸1, 雷氏嵩草 tyr1,和野生型 雷蒂克雷氏菌 起始培养物在 3 ml HS-葡萄糖培养基中生长,含有 2% 纤维素酶,0.5 g/l−1 酪氨酸,10 μM CuSO4 如果合适,340 μg/ml−1 氯霉素,在摇动条件下24小时。 培养物的 OD 标准化600 并接种到含有25ml相同先前培养基的摇瓶中48小时。 此时,通过离心沉淀细胞,并将上清液转移至冰上的单独容器中。 使用0.2μm过滤器对上清液进行灭菌,并通过1M NaOH滴定将pH调节至pH 7。 将细胞沉淀重悬于真黑素发育缓冲液中,并将 10 μl 所得混合物与 pH 调节的上清液样品和 pH 调节的细胞培养物一起放入 384 孔板中。 一旦充满,将反应板离心 10 秒,将液体吸至孔底部,然后用 Breath-Easy 密封膜密封。 使用与真黑素生产测定中使用的相同方案运行测定板。
润湿性实验
K. rhaeticus ptyr1 接种于24孔深孔板中,每孔含5ml HS-葡萄糖培养基,0.5g/L−1 酪氨酸,10 μM CuSO4 和 340 微克/毫升−1 氯霉素。 30℃培养7天后,收集薄膜。 通过将收集的薄膜放入真黑素显色缓冲液中来启动真黑素的产生。 一组薄膜被阻止产生真黑色素,并放入含有 0.5 g/l 的醋酸盐缓冲液中−1 酪氨酸和 10 μM CuSO4 pH 3.6 作为阴性对照。 将黑化和未黑化的表膜放入 70% 乙醇中过夜进行灭菌。 然后用蒸馏水洗涤薄膜以除去残留的乙醇和盐。 然后使用设定为 120°C 和 1 吨压力的热压机将薄膜干燥平整。 这一过程平均使薄膜质量减少 98%。 为了促进干燥并防止薄膜粘附在压机上,将薄膜夹在三层滤纸之间。 使用 KRUSS EasyDrop 和 1 μl 水进行润湿性测试。 每个接触角测量值均源自水滴与薄膜表面接触 10 秒内拍摄的 10 个背靠背水滴图像的平均接触角。
拉伸强度实验
K. rhaeticus ptyr1 接种于含有 50 ml HS-葡萄糖培养基的 15 cm 见方培养皿中,加入 0.5 g/l−1 酪氨酸,10 μM CuSO4 和 340 微克/毫升−1 氯霉素。 在30°C孵育7天后,收集薄膜并切成两半。 将一半放入真黑素显色缓冲液中以启动真黑素生成,另一半放入含有 0.5 g/l 的醋酸盐缓冲液中−1 酪氨酸和 10 μM CuSO4 pH 值 3.6 可防止真黑素产生。 30°C 振荡 24 小时后,将黑化和未黑化的薄膜从各自的缓冲液中取出,并在 70% 乙醇溶液中灭菌过夜。 然后用蒸馏水清洗薄膜,以除去真黑素发育过程中残留的乙醇和盐。 然后使用设定为 120°C 和 1 吨压力的热压机将薄膜干燥平整。 此过程平均可使薄膜质量减少 98%。 使用Zwick ZCP 020手动切割机从干燥的纤维素中切割出35毫米长的狗骨测试样本。 薄膜样本末端使用 Everbuild Stick 2 强力胶通过卡片加固。 在每个样本的表面上标记点以用于位移的光学测量。 使用银笔点黑化纤维素以产生光学测量位移所需的对比度。 使用 Deben Microtest 拉伸台进行拉伸测试,使用 200N 的称重传感器和 0.5 mm/min 的十字头速度−1。
扫描电子显微镜
将未黑化的薄膜放入 pH 3.6 的酸性乙酸盐缓冲液中制备,该缓冲液可阻止真黑素的合成,并在与黑化的薄膜相同的条件下在真黑素显影缓冲液浴中孵育。 通过以下步骤制备用于 SEM 的黑化和未黑化薄膜。 将未灭菌的薄膜置于20%乙醇溶液中并轻轻摇动1小时,然后取出并放入40%乙醇溶液中并轻轻摇动。 对 60%、80% 和 100% 乙醇溶液重复此过程,以确保纤维素基质中的乙醇最大限度地替代水。 然后将薄膜在液氮中快速冷冻并冷冻干燥直至完全干燥。 然后将完全干燥的薄膜固定在铝螺柱上,溅射镀金,并使用 Zeiss Auriga Gemini FEG FIB-SEM 在 5 kV 下成像。
光学显微镜
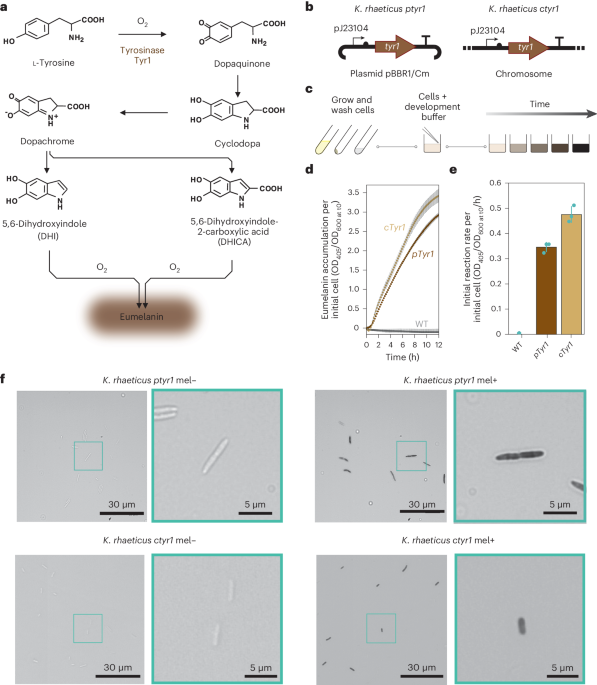
K. rhaeticus ptyr1 和 雷蒂克雷氏菌 ctyr1 分别接种到 3 ml 含有 2% (vol/vol) 纤维素酶和 340 μg ml 的 HS-葡萄糖培养基中−1 氯霉素并在 30°C 下振荡生长直至浑浊。 然后通过离心沉淀混浊的培养物,用1ml PBS洗涤并分成两个单独的1.5ml离心管。 然后再次沉淀细胞。 将一个沉淀物用 500 μl 真黑素发育缓冲液重悬以启动真黑素产生,将另一个沉淀物用 500 μl PBS 重悬以保持细胞不黑化。 将细胞在 30°C 下孵育 24 小时以上,此时含有真黑素发育缓冲液中的细胞的管已变黑。 为了准备显微镜载玻片,将 1 μl 黑化和未黑化细胞置于单独的 1% 琼脂糖垫上,并在带有 ×40 物镜的 Nikon Ti-EX1 倒置显微镜上成像。 细胞在无相差的明视场中成像,以准确地呈现细胞的阴影。
薄膜横截面
雷蒂克雷氏菌 WTK. rhaeticus ptyr1 和 雷蒂克雷氏菌 ctyr1 接种到含有 50 ml HS-葡萄糖培养基的两孔深孔板中,加入 0.5 g/l−1 酪氨酸,10 μM CuSO4 和 340 微克/毫升−1 氯霉素。 30°C 孵育 10 天后,收集薄膜并放入真黑素发育缓冲液中。 24小时后,通过高压灭菌对薄膜进行灭菌。 然后将薄膜放入 -20°C 冰箱中 24 小时,以尽量减少切片过程中的压缩。 使用 Leica DB80LX 刀片手动对冷冻薄膜进行切片,并使用微距镜头 (Leica) 在 RS Pro 灯箱上成像。
颜色耐水斑性
雷蒂克雷氏菌 聚酰亚胺1 和 雷蒂克雷氏菌 酪氨酸1 接种于12.5×16.5cm2 两孔玻璃容器,装有 200 ml HS-葡萄糖培养基,含 0.5 g l−1 酪氨酸、10 μM CuSO4 和 340 μg/ml−1 氯霉素。 30°C 孵育 7 天后,收集薄膜。 通过将薄膜放入真黑素显影缓冲液中来启动真黑素的产生。 30°C 振荡 24 小时后,从缓冲液中取出薄膜并在 70% 乙醇溶液中灭菌过夜。 然后用蒸馏水洗涤薄膜以除去乙醇和剩余的盐。 为了使材料在干燥后柔韧,将复制的薄膜置于 0% 或 5% 甘油溶液中过夜。 然后使用设定为 120°C 和 1 吨压力的热压机将薄膜干燥平整。 为了促进干燥并防止薄膜粘附在压机上,将薄膜夹在三层滤纸之间。 水斑测试改编自 ISO 105-E07:2010 标准。 将去黑化的薄膜固定在 RS Pro 灯箱上,并将 50 μl 蒸馏水点样到每个样品上,一式三份。 在水点之前、之后立即和之后 16 小时对薄膜进行成像,并评估颜色变化。
图案化 米樱桃 表达式为 雷蒂克雷氏菌
pOpto-T7RNAP*(563-F2)-米樱桃 薄膜
建造了一个定制的投影装置,将光投射到生长的薄膜上(扩展数据图 1)。 7b)。 它含有醋酸酯透明材料,其中含有各种成分,可以测试薄膜中图案的质量。 图像透明度是在 Adobe Illustrator 中设计的,并在 HP LaserJet 500 MFP M570 上打印。 将四张醋酸酯透明胶片相互堆叠以形成最终的透明胶片。 然后将其密封在载玻片之间并固定至上部实验室环夹。 将薄膜容器灭菌并填充 500 ml HS-葡萄糖培养基,其中含有 0.1%(wt/vol)阿拉伯糖、1%(vol/vol)乙醇和 170 μg ml−1 氯霉素。 然后用 1 毫升的培养基接种 雷蒂克雷氏菌 pOpto-T7RNAP*(563-F2)-米樱桃 甘油等分试样,并将玻璃盖放置在容器顶部。 在放置之前先加热该玻璃盖,以防止其上形成冷凝并使投影变形。 然后打开LED灯,用一张黑卡关闭镜头。 在约 30°C 下放置 3 天后,形成了薄薄的薄膜。 镜头被揭开,来自透明胶片的图像聚焦在薄膜上。 一旦薄膜暴露于投影图像 3 天,就使用 FLA-5000 荧光扫描仪(Fujifilm)收集并扫描薄膜。 使用 OpenCV Python 库进行图像分析。
图案化 酪氨酸1 表达式为 雷蒂克雷氏菌 Opto-T7RNAP(563-F1)-酪氨酸1 薄膜
使用商用 LED 投影仪 (ViewSonic M1) 的定制装置将光线投射到生长的薄膜上(扩展数据图 1)。 7e)。 装备上覆盖着遮光织物以消除外部光线。 在 Adobe Illustrator 中设计了延时图像,以测试给定的薄膜需要暴露在光线下多长时间才能观察到可识别的色素沉着变化。 在此图像中,蓝色由 RGB 值 (0, 0, 255) 表示,青色由 (0, 255, 255) 表示,白色由 (255, 255, 255) 表示,黑色由 (0, 0, 0) 表示(如图。 4小时)。 将薄膜容器灭菌并填充1升椰子水介质,含有1%(重量/体积)阿拉伯糖,0.5克升−1 我-酪氨酸,10 μM CuSO41% (vol/vol) 乙醇和 200 µg ml−1 奇霉素。 然后用 1 毫升的培养基接种 雷蒂克雷氏菌 Opto-T7RNAP(563-F1)-t一岁 甘油等分试样和培养容器用箔覆盖。 虽然这个版本的光遗传学装置确实包含加热器,但实际上,我们发现这只能在将生长区域加热到高于室温 1-2°C 时有效。 在接近室温(~20°C)的条件下放置 8 天后,形成了一层薄薄的薄膜。 然后除去箔片,投影仪聚焦在薄膜表面,开始播放 80 小时的视频。 80 小时后,收集薄膜并放入含有 2 l 浓缩真黑素显影缓冲液的 300 × 400 mm Eurobox 中,并在 30 °C 的静止条件下进行显影,直至识别出可辨别的图案。 然后将薄膜在 dH 中清洗2O 去除未积聚在表膜内的真黑色素。 使用 Amersham Typhoon 扫描仪 (GE) 进行薄膜的光密度扫描,并设置为 digi-blue 数字化设置。
表征 米樱桃 表达光遗传学菌株
雷蒂克雷氏菌 Opto-T7RNAP 菌株携带 pT7-mCherry 质粒和 雷蒂克雷氏菌 pOpto-T7RNAP*(563-F2)-米樱桃 在黑暗中培养,在 3 ml 含有 2% 纤维素酶的 HS-葡萄糖培养基中摇动,其中含有 200 μg ml 的壮观霉素−1 或氯霉素 340 μg ml−1 取决于质粒。 当所有培养物都变得浑浊时,OD600 测量并将培养物全部稀释或浓缩至 OD600 1,然后接种(比例为 1:10)到 96 孔深孔板中,其中含有 270 μl HS-葡萄糖培养基(含 2% 纤维素酶)和 0、1、10 或 100 mg/ml−1 阿拉伯糖。 适当时,大观霉素 200 μg/ml−1 和氯霉素 340 μg ml−1 被添加到孔中。 在黑暗中 30°C 振荡生长 18 小时后,将细胞分装到两个透明的 96 孔板中,以 1:2 的比例稀释到具有匹配阿拉伯糖浓度的新鲜培养基中。 将一块板放在蓝色 LED 泛光灯下的摇床上,另一块板用箔纸包裹并放在同一摇床上。 两个板均用 Breath-Easy 密封膜密封。 在30℃两种光照条件下快速振荡6小时后,将细胞放入读板机中,使用590 nm的ex和645 nm的em测量每个孔中的红色荧光以及OD处的细胞密度600。
表征 酪氨酸1 表达光遗传学菌株
Opto-T7RNAP 雷蒂克雷氏菌 菌株携带 pT7-酪氨酸1 质粒和 雷蒂克雷氏菌 pOpto-T7RNAP(563-F1)-提尔 以与 mCherry 菌株相同的方式培养,不同之处在于 HS-葡萄糖补充了 0.5 g/l−1 酪氨酸和 10 μM CuSO4。 将细胞暴露于蓝光的方法也与 mCherry 菌株相同,不同的是,在暴露时间 6 小时后,将两个板进入真黑色素产生测定程序。 将两个板放置在 OT-2 平台上,并将两个板的样品与 384 孔反应板中的真黑素显色缓冲液混合。 在 384 反应板中对两个 96 孔板中的每个孔进行两次采样,为每个孔提供两次技术重复。 然后在分析过程中对这两次重复进行平均。
报告摘要
2024-04-02 00:00:00
1713183844